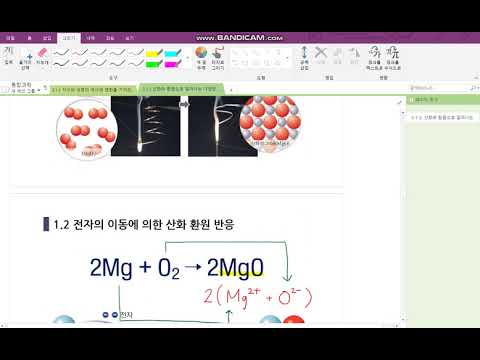
콘텐츠

산화 마그네슘과 물의 조합은 열 방출과 함께 수산화 마그네슘을 생성합니다. 과학자들은이 반응을 사용하여 열을 화학 에너지로 저장 한 다음 열로 변환 할 수있는 방법을 개발했습니다.
산화 마그네슘
산화 마그네슘 (화학식 : MgO)은 미네랄 periclase로 자연적으로 발생합니다. 산화 마그네슘은 순수한 형태의 흰색이지만 페리클레스는 주로 산화철 (III)과 같은 다양한 불순물의 존재로 인해 회색, 노란색 또는 갈색 외관을 나타냅니다.
산화 마그네슘과 물
산화 마그네슘은 물에 노출되면 수산화 마그네슘으로 전환됩니다 : MgO + H2O → Mg (OH) 2. 이 반응은 매우 발열 적입니다 (열 방출).
수산화 마그네슘
산화 마그네슘과 물의 조합으로 생성 된 수산화 마그네슘은 약간의 용해도를 나타냅니다. 0.0009g은 18ºC에서 100ml의 물에 용해됩니다. 이 반응에 의해 생성 된 수산화 마그네슘은 염기성 화합물로 물의 pH를 낮 춥니 다. pH 측정은 용액의 산도 또는 염기도를 0에서 14까지의 척도로 나타내며, 7 미만의 pH는 산성이고 pH 7은 염기성이며 pH 7은 중성입니다. 수산화 마그네슘은 염기성 및 용해성이 부족하여 처방전없이 제산제로 적합합니다.
용도
Tokyo Institute of Technology의 그룹을 포함한 여러 연구자들은 산화 마그네슘과 물의 반응에 기반한 화학적 열 펌프를 시연했습니다. 이 펌프는이 경우 태양 광 패널 또는 공장의 배출 파이프에서 생성 된 열을 포착하여 열 에너지를 저장합니다. 열은 수산화 마그네슘을 산화 마그네슘으로 전환합니다 (수산화물을 탈수시킵니다). 그런 다음 요청시 열을 방출하여 물로 탈수 된 산화 마그네슘을 노출시켜 산화 마그네슘을 다시 수산화 마그네슘으로 전환 할 수 있습니다. 이러한 시스템은 수산화 마그네슘 1kg 당 240kjoule 이상의 열을 저장할 수 있으며, 이는 물 57 리터의 온도를 1ºC로 올리기에 충분한 양입니다.
호기심
수산화 마그네슘은 "마그네시아 우유"의 주성분입니다. 마그네슘은 지각 질량의 2.1 %를 차지하는 지각에서 8 번째로 가장 풍부한 원소입니다.


